위소매절제술 이후 발생한 지연성 저혈당뇌병증
Delayed Hypoglycemic Encephalopathy after Sleeve Gastrectomy
Article information
Trans Abstract
Sleeve gastrectomy may cause hypoglycemia and the symptoms usually are mild such as sweating, nausea, headache. It rarely results in irreversible neurologic deficit. A 34-year-old woman, who has past history of sleeve gastrectomy, was admitted due to acute onset of unconsciousness. Brain imaging revealed hypoglycemic encephalopathy but there is no other possible causes of hypoglycemia except sleeve gastrectomy. In clinical aspect, we suggest that clinicians should consider sleeve gastrectomy as possible cause of hypoglycemia if there were no other causes of hypoglycemia.
글라스고우 혼수척도(Glasgow coma scale) 8점 미만의 의식변화를 보이는 저혈당뇌병증은 주로 인슐린이나 당뇨병 치료약, 신경내분비암종, 과음, 부신부전 등에 의하여 나타난다[1]. 위소매절제술로 나타나는 저혈당에서는 일반적으로는 발한, 심계항진, 오심, 두통과 같은 가벼운 증상이 나타나며 심하면 실신, 경련이 일어나게 되나 이러한 현상은 극히 드물다고 알려져 있다[2]. 저자들은 당뇨병이 없는 환자에서 위소매절제술 이후 발생한 불가역적 저혈당뇌병증을 경험하여 이를 보고하고자 한다.
증 례
34세 여자가 원인불명의 혼수상태로 응급실에 내원하였다. 발견 당시 구조대에서 확인한 혈당수치는 13 mg/dL였으며, 방문시 혈압은 90/60 mmHg이었고, 맥박은 94회, 호흡수는 18회/분, 체온은 섭씨 36.2도였다. 방문 후 시행한 심전도와 단순 흉부 촬영영상은 정상이었다. 신경학적 진찰에서 양측 동공 크기는 대칭적이었으나 대광반사가 저하되어 있었으며, 자극을 줄 때 피질제거자세를 보였다. 바빈스키징후가 양측에서 보였으며 다른 병적반사는 보이지 않았다. 전정안반사와 각막반사는 정상적이었다. 혈액검사에선 백혈구증가증과 횡문근융해 소견을 보였다(white blood cell count 15,580/uL [정상 4,000-10,000], creatine kinase 3,815 IU/L [정상 22-169], myolgobin 1,016.5 mg/mL [정상 14.3-65.8]). 방문 당일 시행한 뇌 전산화단층촬영영상(computed tomography)에서 두정엽 피질과 피질하조직의 경계가 불분명해졌으며 확산강조영상(diffusion-weighted imaging)에서 양측 피질하조직에 전반적인 제한확산(restricted diffusion)을 보였다(Fig. 1A, B). 그 외 대뇌 피질, 기저핵, 시상에는 병변이 없었다. 다음날 뇌자기공명영상(magnetic resonance image)을 추적 관찰하였으며 이전의 소견에 비하여 양측 대뇌 피질, 속섬유막, 뇌량의 침범이 추가로 확인되었고, 조영증강영상과 자기공명혈관조영 영상에서 특이 소견은 보이지 않았다(Fig. 1C, D). 뇌파검사에서 발작파는 없으며 전반적인 뇌기능저하가 확인되었다.
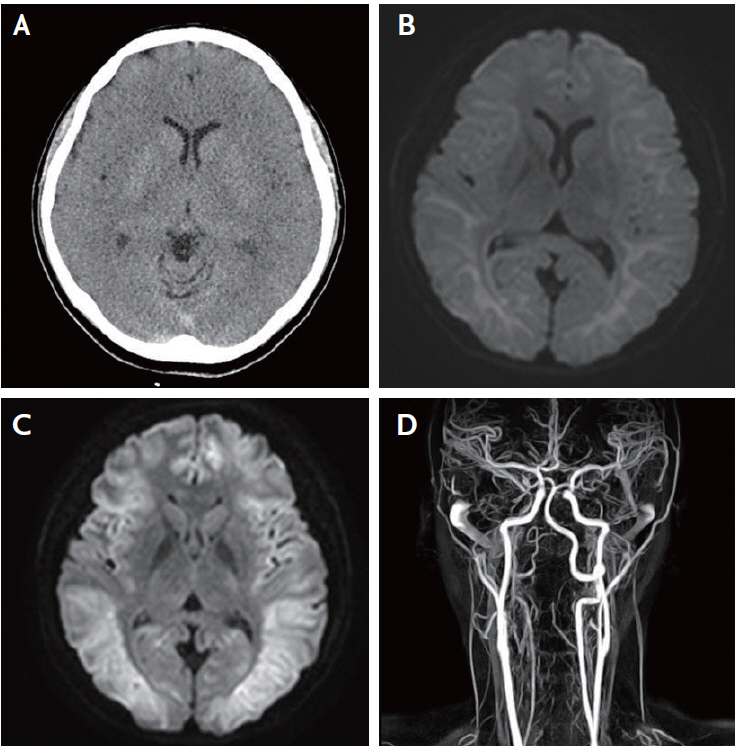
Computed tomography and magnetic resonance imaging at admission and follow-up. Brain computed tomography, magnetic resonance imaging and magnetic resonance angiography imaging conducted on the first 2 days. (A) Brain computed tomography showed diffuse low density lesions on both cerebral hemispheres. (B) Initial magnetic resonance imaging revealed diffuse high signal intensity on both white matter expanded to cortex, corpus callosum and left internal capsule posterior limb, suggesting hypoglycemic encephalopathy. (C) A day after onset, follow-up magnetic resonance imaging revealed aggravated diffuse high signal intensity on bilateral hemispheres. (D) Magnetic resonance angiography imaging showed no vascular abnormality.
보호자 진술에 따르면, 환자는 과거 의식저하상태를 보이거나 뇌전증 병력은 없었으며 당뇨병으로 진단받은 과거력도 없었다. 환자가 주요 우울장애를 진단받는 적은 없으나 평소 죽고 싶다고 반복적으로 말하였고, 방문 전일도 보호자들과 크게 다툰 후 방에 들어갔지만 자해의 흔적은 보이지 않았다. 7년 전에 100 kg가 넘는 비만이 있어 베리아트릭 수술을 받았으며 그 종류는 확인되지 않았다. 수술 후 복용해온 약제들은 체중감소 보조약물(orthosiphon powder)과 다이어트 목적의 이뇨제, 피부 알레르기 때문에 먹는 항히스타민계열 약물들로 저혈당을 유발한다고 알려진 약물은 없었다. 부신부전을 확인하기 위하여 혈액검사(인슐린, C-펩티드, 코티솔)를 시행하였으며 특이 소견은 없었다. 함께 시행한 복부 골반전산화단층촬영(abdomen-pelvis CT)에서는 저혈당을 일으킬 수 있는 종괴는 보이지 않았으며, 위가 관 모양으로 보여 이전 환자가 받은 수술이 위소매절제술로 확인되었다(Fig. 2). 이를 종합하여 저자들은 본 환자를 위소매절제술 이후 발생한 저혈당뇌병증으로 진단하였다.
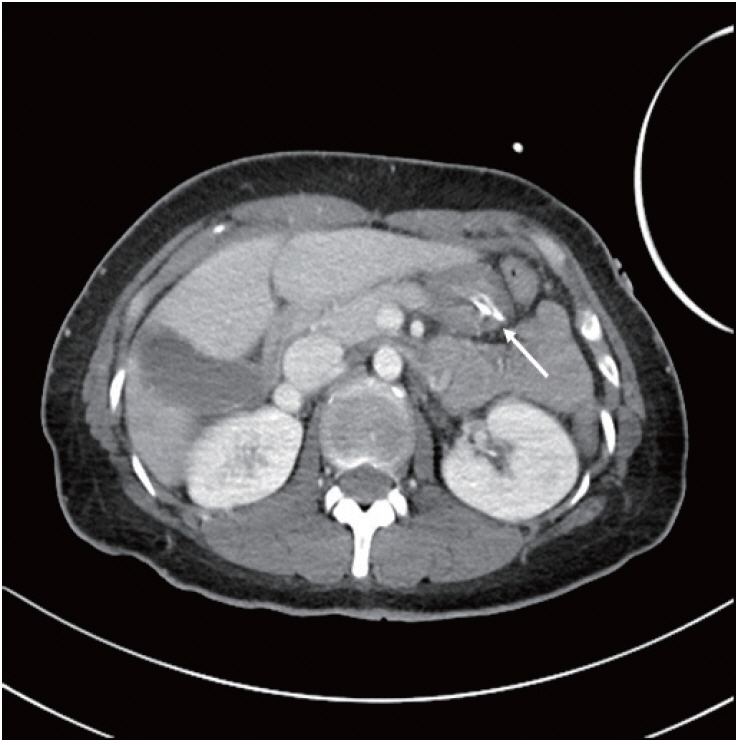
Abdomino-pelvic computed tomography. In abdomino-pelvic computed tomography, history of sleeve gastrectomy was revealed by tubular shape stomach, but there is no mass-like lesion like carcinomas or insulinoma (arrow).
입원 5일째 시행하였던 뇌파검사에서 경련파는 보이지 않았으나, 환자는 간헐적으로 10초 정도씩 전신적인 근간대발작 양상으로 몸을 떠는 모습을 보였고 이에 뇌 손상 후 경련을 의심하여 levetiracetam 500 mg을 하루 2회 투약하였다. 입원 10일째 뇌파검사에서 뇌의 전반적인 기능저하가 더욱 두드러지게 나타났으며, 환자는 이후로도 의식을 회복하지 못하였고 기관절개술 후 전원되었다.
고 찰
저혈당은 다양한 증상과 징후를 일으킬 수 있는데, 가볍게는 떨림, 심계항진, 발한으로부터 심한 경우 인지기능 변화, 의식저하, 실신, 경련까지 나타날 수 있다. 이는 더 심하고 지속적으로 있을 경우 저혈당뇌병증이 유발되기도 하며 혈당이 회복된 후에 의식 소실이 지속되기도 한다. 일반적으로는 인슐린이나 당뇨병 치료약이 가장 흔한 원인이고 당뇨병 환자에서 더 자주 나타난다고 보고되었다[1].
신체질량지수(body mass index) 40을 초과하는 심각한 비만 환자에서 체중감량을 목적으로 시행되는 베리아트릭 수술도 저혈당의 원인으로 알려져 있고, 그중 하나인 위소매절제술은 두 가지 방향으로 체중감소에 관여한다. 첫째, 위의 용적이 줄기 때문에 물리적으로 식사량이 함께 줄어들어 체중이 감소하는 효과가 있다. 둘째, ghrelin과 glucagon-like peptide-1 (GLP-1) 등을 포함하는 식사 및 소화와 관련된 호르몬의 변화이다. Ghrelin은 식욕을 촉진하는 호르몬으로, 수술로 위의 기저부가 절제되면 분비량이 줄어들어 식욕이 억제된다. GLP-1은 소장에서 분비되어 위배출을 지연시키고 glucagon의 역할을 억제, 인슐린 분비를 증가시키는 호르몬으로 수술 후 상승한다. 하지만 이러한 호르몬의 변화는 부작용으로 저혈당을 일으키기도 한다.
한 연구에 따르면 450명의 베리아트릭 수술(루앵Y 우회로조성술, 위소매절제술 포함)을 받은 사람들 중 11.6%의 환자들에서 타인의 도움이 필요하거나 실신, 경련 등 심각한 저혈당 증상이 나타났다고 보고된 바 있다[2]. 저혈당을 일으키는 기전으로는 첫째, 수술 전 베타세포의 비대가 기능 항진을 유발, 둘째, GLP-1과 같은 incretin 호르몬의 부적절한 분비 과다, 셋째, glucagon과 같은 역조절 호르몬의 이상, 넷째, 체중감량 이후 과도한 인슐린 감수성 증가의 네 가지 가설이 제시되었다[3]. 두 가지 수술 모두 비슷한 기전을 가지나, 루앵Y 우회로조성술보다 위소매절제술에서 음식물이 지나는 경로의 차이로 펩티드 YY와 GLP-1이 더 적게 증가하여 저혈당이 더 적게 나타나는 것으로 알려져 있다[4,5].
뇌 영상은 예후 평가에 도움이 된다고 알려져 있는데, 뇌 자기공명영상에서 병변이 속섬유막이나 뇌량에 국한되며 추적 관찰에서 사라지면 좋은 예후를 보이고, 대뇌피질조직, 기저핵을 침범하며 추적 관찰에서 소실되지 않으면 나쁜 예후를 보였다[6]. 다른 보고에서는, 다른 예후예측인자는 명확치 않으나 초기 영상에서 정상 소견을 보였을 때 예후가 좋다고 보고되었다[1]. 또한 저혈당의 예후는 지속시간과 관련성이 크며, 한 연구에서는 지속시간이 8시간 이상일 때 mRS 3점 이하의 좋은 예후를 보인 경우는 없다고 보고하였다[1]. 본 증례의 경우 입원 당시부터 전반적인 백질의 병변이 있었으며 추적 관찰 영상에서 대뇌피질, 속섬유막, 뇌량의 침범이 확인되었으므로 영상학적으로 나쁜 예후가 예상되었고, 정확한 기간은 알 수 없었으나 마지막으로 정상으로 확인되었던 저녁 9시부터 발견된 시각인 아침 9시까지의 최장 12시간 동안 저혈당이 지속되었을 것으로 추정한다. 이러한 저혈당은 이전 연구에 모인 증례들에 따르면 모두 수술 이후 6개월 이상 지나서 나타났으며(6개월-8년) [7], 본 증례에서 수술 7년 이후 증상이 발현한 것 역시 가능함을 설명해준다. 하지만 이러한 베리아트릭 수술 이후의 심각한 저혈당증의 원인으로 췌도세포증(nesidioblastosis) 등 여러 가지 가설이 있으나, 수술 직후엔 없다가 수개월에서 수년 후에 나타나는 이유까지는 아직 밝혀지지 않았다[8].
본 증례에서 보인 34세의 낮은 연령은 위소매절제술에서 저혈당이 잘 나타나게 하는 위험인자로 알려져 있지만[9,10], 현재까지 위소매절제술과 관련되어 나타난 저혈당뇌병증은 보고된 예가 없다. 이에 당뇨병이 없는 환자에서 저혈당이 발생한 경우, 수술력을 확인하는 것과 더불어 드물지만 위소매절제술 후 합병증으로 저혈당뇌병증이 나타날 가능성을 고려할 필요가 있음을 본 증례를 통해 보고하는 바이다.